
Les vaccins et l’obligation vaccinale (2de partie)
Après avoir rappelé l’histoire des vaccins à travers le monde, ainsi que les différents types, intéressons-nous-y de plus près. Qu’entend-on par « autorisation de mise sur le marché ». Que représente ce terme, à quoi correspond-il ? Sur les vaccins les avis divergent dans les différents médias, les uns pour, les autres contre, et sans aborder l’obligation vaccinale. Quelle est leur composition ? Comment m’informer ? Quels sont les effets indésirables ? Quelles sont leurs efficacités ?
Comme tout médicament, le vaccin suit un processus afin de devenir une solution administrable. Le Graal est l’autorisation, et aboutissement, de mise sur le marché, cela représente un long chemin semé d’embûches. La première étape est la production de la substance active :
- banque de germes
- mise en culture et amplification
- récolte
- purification et concentration
- inactivation et fabrication des valences
Elle est soumise à divers paramètres (la température, le potentiel hydrogène, le taux d’oxygène, la stérilité et l’homogénéité). Cette étape primordiale peut durer quarante-huit heures à trois mois en fonction des vaccins recherchés. Les antigènes produits à partir de micro-organisme sont alors récoltés. Vient la purification, qui est l’extraction des virus ou bactéries de leur environnement. Puis la pathogénicité est supprimée (neutralisation du virus ou de la bactérie pour l’empêcher de se propager), en conservant bien entendu les propriétés immunologiques, c’est la phase d’inactivation. Enfin la production des valences antigéniques, qui dans le cas des vaccins correspond à la protection apportée pour un germe et un seul. Un vaccin peut être monovalent (agis contre un seul germe) ou plurivalent (agis contre plusieurs germes différents). La seconde étape est la Mise en forme pharmaceutique. Elle se définit par :
- Assemblage des valences pour les vaccins combinés
- Formulation
- Répartition
- Lyophilisation
- Conditionnement
- Contrôle des lots
- Livraison
Le vaccin peut donc être monovalent comme plurivalent. Alors les combinaisons de valence ne doivent en aucun cas interférer entre elles pour garder l’efficacité du vaccin. C’est pourquoi cela requiert des années de recherche et de développement scientifiques. Des adjuvants, stabilisateurs, et conservateurs sont ajoutés en très petites quantités pour améliorer l’efficacité et la stabilité du vaccin. Le remplissage est le chapitre subséquent, la lyophilisation si nécessaire permet une meilleure conservation. La température des produits pendant les transports est strictement contrôlée et suivie. Les laboratoires constituent des tests, effectuent des prélèvements d’échantillons sur chaque lot envoyés aux instances de santé pour contrôle de qualité. C’est alors que la livraison débute.

Puis, viennent les essais cliniques chez l’être humain qui se déroulent en quatre phases. Les essais de la Phase I ont lieu généralement sur quelques dizaines de volontaires. Ils observent les éventuels effets secondaires très fréquents (en comparant avec un placebo ou un vaccin connu). Ils permettent également de déterminer la meilleure dose de vaccin expérimental, en mesurant les anticorps produits par lesdits volontaires. Les essais de Phase II élargissent les connaissances, en incluant plusieurs centaines, voire milliers de volontaires, ce dans plusieurs centres cliniques différents. Les individus sont suivis pendant plusieurs mois, notamment pour observer l’évolution dans le sang de leurs taux d’anticorps ou de lymphocytes B et T. Cette étape permet d’étudier les détails de la réponse immunitaire, de préciser les schémas d’administration (nombre de doses, etc.), et d’identifier les effets secondaires fréquents. Les essais de Phase III incluent plusieurs dizaines voire centaines de milliers de volontaires pour répondre à la question : « Le vaccin protège-t-il contre la maladie ? ».

Il s’agit donc d’observer dans quelle mesure les personnes vaccinées, exposées au microbe, résistent à la maladie dans les semaines et mois après la vaccination. Ces essais à large échelle sont les seuls capables de détecter les effets secondaires rares, ainsi que de définir dans quelles classes d’âge ou groupes de population le candidat-vaccin est efficace, ou non. Enfin, les essais de Phase IV sont réalisés après la commercialisation d’un vaccin pour préciser son utilisation auprès de populations qui n’avaient pas été incluses dans les essais de phase II et III. Il s’agit aussi de vérifier si des effets indésirables très rares, mais grave, surviennent chez les millions de personnes vaccinées.
Le 27 mai 2021, Sanofi et GSK annonçaient le recrutement des participants dans leur étude clinique de phase III. Cette dernière visant à évaluer la sécurité, l’efficacité et l’immunogénicité de leur candidat-vaccin recombinant avec adjuvant contre la COVID-19 a débuté. Dans le cadre de cette étude internationale de phase III, randomisée, en double aveugle, contrôlée par placebo, plus de 35 000 volontaires âgés de 18 ans et plus seront mobilisés dans différentes nations, dont les États-Unis et plusieurs pays d’Asie, d’Afrique et d’Amérique latine.
De plus, le manque d’explication peut engendrer des colères. « En devenant volontaire à des essais cliniques vaccinaux contre la COVID-19, chacun peut devenir acteur de la lutte contre la pandémie, faire avancer la recherche et ainsi contribuer sur le moyen terme à se protéger et à protéger chaque Français et notamment les populations les plus fragiles. Devenir volontaire, c’est aussi laisser la possibilité à des enfants et adolescents de prendre part à ces essais vaccinaux », rédige sur son site Covireivac. Le projet destiné à la recherche clinique vaccinale COVID-19 est coordonné par l’INSERM. Les études cliniques sont effectuées pour tous médicaments. Le programme du français Sanofi avec l’anglais GSK semble être intimement lié avec ce qu’écrit Covireivac. Pour cela que l’EMA entame l’examen continu du vaccin Vidprevtyn Share de Sanofi Pasteur depuis le 20 juillet 2021.
Autorisation de mise sur le marché
Le collège de Médecine générale donne accès aux fiches des quatre vaccins contre le virus du SARS-CoV-2 en autorisation de mise sur le marché conditionnelle. Sur le site de l’agence nationale de la sécurité du médicament et des produits de santé (ANSM). « Les Autorisations de mises sur le marché (AMM) seront délivrées par la Commission européenne à l’issue de cette évaluation et seront valables dans tous les États membres de l’UE. Dans le contexte de la pandémie et de l’urgence de santé publique, les AMM seront dites conditionnelles, écrit l’agence nationale sur son site avant de poursuivre. L’AMM conditionnelle rassemble tous les verrous de contrôles d’une autorisation de mise sur le marché standard pour garantir un niveau élevé de sécurité pour les patients. Une fois qu’une AMM conditionnelle a été accordée, les laboratoires doivent fournir les données supplémentaires provenant d’études nouvelles ou en cours dans des délais fixés par l’EMA pour confirmer le rapport-bénéfice/risque positif. » L’autorisation de mise sur le marché conditionnelle est octroyée pour un an et peut être renouvelée. Lorsque les autorités européennes ont reçu et évalué tous les renseignements complémentaires exigés, l’AMM conditionnelle peut être convertie en une AMM standard.
Ci-dessous la composition des différents vaccins ayant l’AMM en France, se référant à l’Agence européenne du Médicament, EMA (NDLR pour traduire différents textes en langues étrangères non maîtrisées, la rédaction utilise le site deepl).
| Vaccin | Cormitary de Pfizer-BioNtech (à ARNm à nucléoside modifié) | Moderna (à ARNm à nucléoside modifié) | Janssen de Johnson & Johnson (à vecteur viral vivant non réplicatif, adénovirus de type 26) | AstraZeneca (à vecteur viral non réplicatif , adénovirus de chimpanzé) |
|---|---|---|---|---|
| Antigène | ARNm COVID-19, incorporé dans des nanoparticules lipidiques 30 μg | 100 μg d’ARN messager encapsulé dans les nanoparticules lipidiques SM-102 | au moins de 8,92 log10 unités infectieuses (U.I.) | Au moins 2,5 × 108 particules virales (U.I.) de l’Adénovirus codant la glycoprotéine Spike du SARS-CoV-2 (ChAdOx1-S) |
| Excipients | ALC-0315 = bis(2-hexyldécanoate) de ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyle) | Lipide SM-102 | Éthanol (environ 2 mg par dose) | Éthanol (environ 2 mg dans une dose) |
| ALC-0159 = 2-[(polyéthylèneglycol)-2000]-N,Nditétradécylacétamide | Cholestérol | HBCD (2-hydroxypropyl-β-cyclodextrine) | Chlorhydrate de L-histidine monohydraté | |
| 1,2- distéaroyl-sn-glycéro-3-phosphocholine (DSPC) | DSPC | Acide citrique monohydraté | Chlorure de magnésium hexahydraté | |
| cholestérol | 1,2- dimyristoylrac-glycéro-3-méthoxypolyéthylène glycol-2000 (PEG-2000 DMG) | Citrate trisodique dihydraté | Édétate de disodium (dihydraté) | |
| Chlorure de potassium | Trométhamine | Polysorbate-80 | L-Histidine | |
| Phosphate monopotassique | Chlorhydrate de trométhamine | Chlorure de sodium | Chlorure de sodium | |
| Chlorure de sodium | Acide acétique | Hydroxyde de sodium | Polysorbate 80 (E 433) | |
| Phosphate disodique dihydraté | Acétate de sodium trihydraté | Acide chlorhydrique | Saccharose | |
| Saccharose | Saccharose | Eau pour préparation injectable | Eau pour préparation injectable | |
| Eau pour préparation injectable | Eau pour préparation injectable |
Pharmacovigilance et effets indésirables présumés
La pharmacovigilance consiste à recueillir des données issues de la surveillance, y compris des informations sur les effets indésirables présumés, d’un médicament, comme d’un vaccin. Que son utilisation soit conforme aux termes de son autorisation de mise sur le marché, ou non (en cas de surdosage, de mésusage, d’abus, ou d’erreurs médicamenteuses). « Les effets indésirables sont généralement notifiés par les professionnels de santé, c’est pourquoi il est conseillé de faire part de vos effets indésirables à votre médecin ou à votre pharmacien. » Le but est de remonter les effets rencontrés durant la Phase IV. L’EudraVigilance (European Union Drug Regulating Authorities Pharmacovigilance) est faite pour. C’est un réseau de traitement des données et le système de gestion, pour la déclaration et l’évaluation des effets indésirables présumés des médicaments. De ceux qui ont été autorisés, ou, qui sont étudiés dans le cadre d’essais cliniques dans l’Espace économique européen (EEE). En date du 19 juillet 2021, sous l’autorité de l’ANSM, une information transmise aux professionnels de la santé sur les risques de myocardite et de péricardite suite à l’injection des vaccins issue de BioNTech-Pfizer et Moderna indique : « Jusqu’au 31 mai 2021, environ 177 millions de doses de Comirnaty et 20 millions de doses de Spikevax ont été administrées dans l’Espace Economique Européen (EEE). Un total de 145 cas de myocardite est survenu chez des personnes ayant reçu le vaccin Comirnaty et 19 cas chez des personnes ayant reçu le vaccin Spikevax. De plus, 138 cas de péricardite sont survenus après l’utilisation de Comirnaty et 19 cas après l’utilisation de Spikevax. »
La base européenne de données des rapports d’effets indésirables susceptible d’être liée à l’utilisation de médicaments affiche en préambule une clause de non-responsabilité. Cela est dû au fait que les chiffres doivent être replacés dans un contexte avec d’autres facteurs, comme le nombre de personnes qui prennent le médicament et la durée pendant laquelle le médicament a déjà été commercialisé. À savoir :
- Les informations présentées sur ce site web ne reflètent aucune confirmation d’un lien potentiel entre le médicament et le(s) effet(s) observé(s).
- Les informations présentées sur ce site web concernent des suspicions d’associations qui reflètent les observations et avis du déclarant.
- Les informations peuvent inclure des effets indésirables connus déjà énumérés dans le résumé des caractéristiques du produit (RCP) et la notice.
- Le nombre d’effets indésirables suspectés d’être liés aux médicaments dans la base de données EudraVigilance (EV) ne doit pas servir de base pour la détermination de la probabilité de la survenue d’un effet indésirable.
- Chaque circonstance individuelle enregistrée dans le système EV concerne en général un seul patient ; cependant, plus d’un effet indésirable a pu être signalé dans un cas. Par conséquent, le nombre d’effets indésirables ne sera pas toujours identique au nombre de cas.
- Les déclarations sur les effets indésirables contenus dans la structure EV ne représentent pas l’ensemble des informations disponibles concernant les bénéfices et les risques d’un médicament […] d’autres sources d’informations (informations sur le produit et en matière de prescription, doivent d’abord être consultées.
- Les patients et les consommateurs ne doivent pas arrêter de prendre leurs médicaments ou en changer sans consultation préalable d’un professionnel de santé.
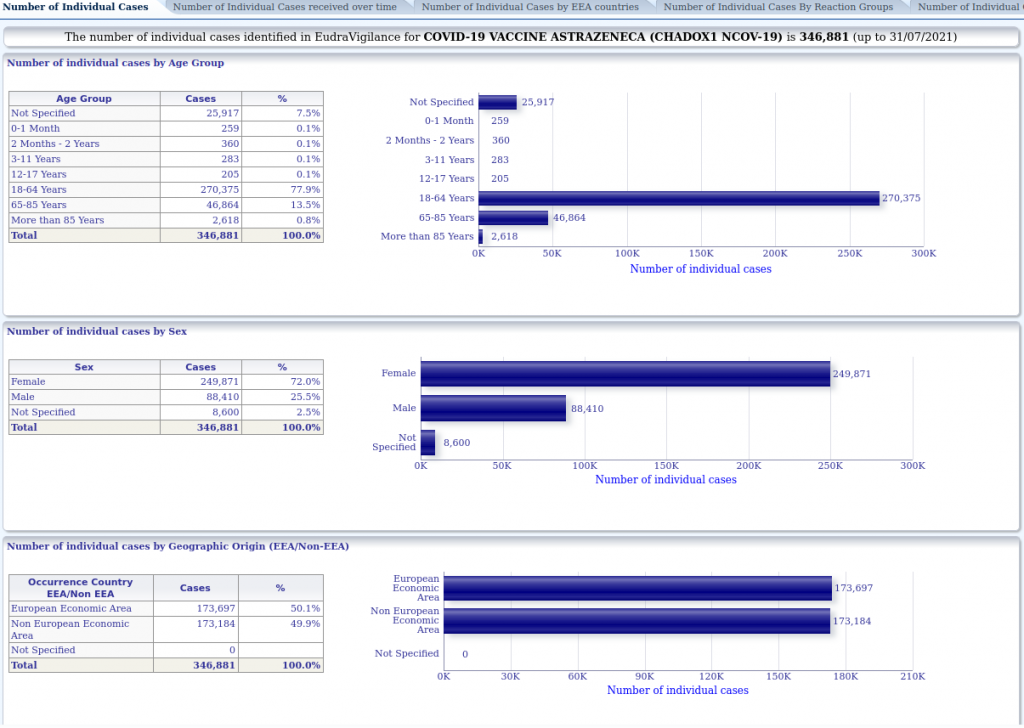
Mais d’autres données sont lisibles par tout un chacun. Le nombre de cas individuels d’effets indésirables identifiés dans EudraVigilance pour le vaccin Moderna contre le virus du SARS-CoV-2 (CX-024414) est de 84 547 (jusqu’au 31/07/2021). Les statistiques concernant Pfizer-BioNTech, AstraZeneca et Janssen des laboratoires Johnson & Johnson révèlent respectivement 327 665, 346 881 et 19 915 cas individuels d’effets indésirables.
Les chiffres en France
Le Premier ministre, Jean Castex, annonçait sur TF1 le 21 juillet dernier que 96 % des 18 000 cas positifs dus au variant Delta, n’étaient pas vaccinés. Or, ce dernier avait commis une erreur ou imprécision, en tout bonne foi. Les services de Matignon confirmaient HuffPost et au Parisien que le chef du gouvernement tirait ce chiffre de 96 % non des dernières données de Santé publique France, mais d’une étude mentionnée par le ministre de la Santé Olivier Véran et menée par la DRESS (Direction de la recherche, des études, de l’évaluation et des statistiques) portant sur la période du 28 juin au 4 juillet. Concernant un homme politique, devons-nous parler d’erreur ou de « Fake News » ?
La Drees au paragraphe 2.1 indique : « Sur la semaine du 28 juin au 4 juillet 2120 tests PCR prélevés positifs par joue en moyenne ». Cela représente donc sur sept jours 14 840 personnes testées. Le nombre de personnes non vaccinées atteint est de 80, 57 %. Le tableau pris en compte dans le dossier communiqué par la Drees est celui, ci-dessous. Il détaille l’effectif de cas L452R (variant Delta) de femmes et d’hommes, vaccinées ou non, avec ou sans symptômes venant effectuer un test RT-PCR.
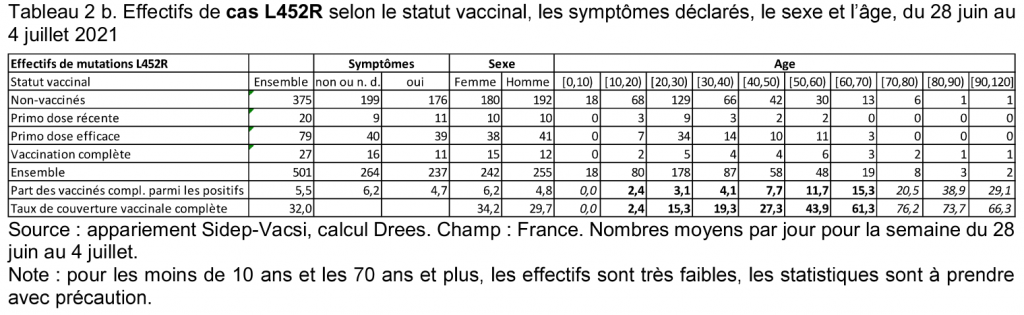
En reportant les données par sexe et en les compilant, cela donne les donnes suivantes.
| TR-PCR Positifs | |||
|---|---|---|---|
| Statut vaccinal | Nombre moyen par jour | Global | L452R |
| Non-vaccinés | 1694 / 374 | 80, 4 % | 74, 8 % |
| Primo dose récente | 57 / 19 | 2, 7 % | 3, 8 % |
| Primo dose efficace | 229 / 79 | 10, 87 % | 15, 8 % |
| Vaccination complète | 127 / 28 | 6, 03 % | 5, 6 % |
| Ensemble | 2107 / 500 | 100 | 100 |
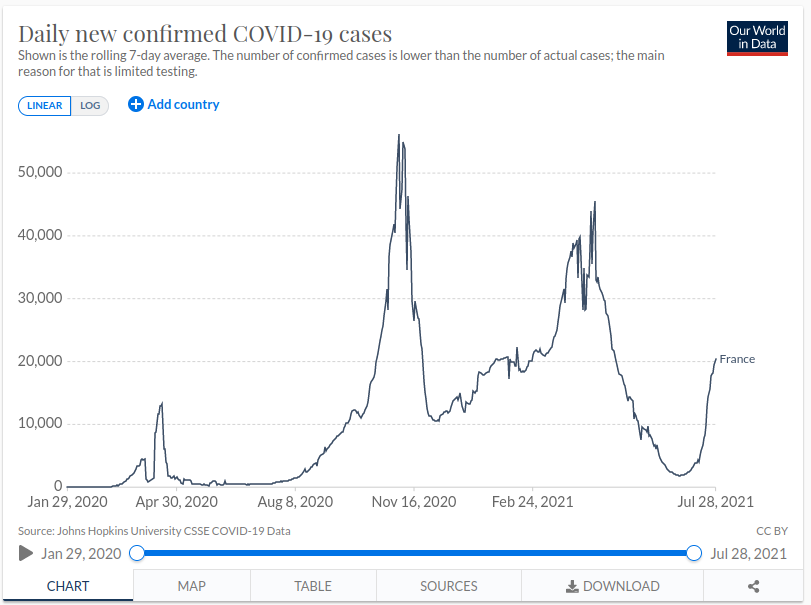
La communication est le sujet prépondérant de tout, ainsi d’innombrables experts s’écharpent depuis le début de la pandémie, non sur le taux de contamination, mais sur celui de la létalité. La définition prodiguée par le centre national de ressources textuelles et lexicales (CNRTL) est le « Rapport entre le nombre de décès dus à une maladie et le nombre de personnes atteintes de cette maladie ». Les données en France par le site« Ourworldindata » à la date du 27 juillet 2021 fournissent le nombre d’êtres humains disparus à 111 883, sur un total d’individus contaminés de 6, 09 millions. Le taux de létalité est de 1, 8371 %. Or, le ratio de mortalité ne tient pas compte des infectés non répertoriés, c’est-à-dire les malades qui n’ont pas eu de test PCR. Ainsi, le taux serait en Italie de 2, 96 %, au Brésil de 2, 79 %, Allemagne 2, 43 %, Iran 2, 38 %, en France de 1, 84 % pour une moyenne mondiale de 2, 14 %.
Les effets indésirables et les bénéfices des vaccins
Les essais de Phase IV profitent de ce que chaque effet indésirable est notifié. En fonction des vaccins ayant reçu l’AMM, l’agence nationale de sécurité du médicament et des produits de santé, met à disposition une fiche récapitulative mentionnant lesdits effets indésirables des vaccins et médicaments. Chaque fait doit être signalé auprès du médecin, de la pharmacie, et en cas de doute il est recommandé de contacter votre praticien traitant, ou le 15.
| Effets indésirables | AstraZeneca | Janssen | Moderna | Pfizer-BioNTech |
|---|---|---|---|---|
| Très Fréquents (≥1/10) | Céphalées, nausées, myalgies, arthralgies, fatigue, malaise, état fébrile, frissons | Céphalées, nausées, myalgies, fatigue, douleur au site d’injection | Fatigue, céphalées, lymphadénopathie, nausées / vomissements, myalgies, frissons, arthralgies, fièvre, douleur au site d’injection | Fatigue, céphalées, myalgies, frissons, arthralgies, fièvre, diarrhée. Réaction au site d’injection (douleur, gonflement au site d’injection) |
| Fréquents (≥ 1/100 à < 1/10) | Vomissements, diarrhées, fièvre, thrombocytopénie, maladie pseudo grippale, asthénie, douleurs dans les extrémités, réaction au site d’injection (gonflement, érythème) | Toux, arthralgie, fièvre, frissons, gonflement et érythème (au site d’injection) | Réaction au site d’injection (érythème, urticaire, rash), éruption cutanée | Réaction systémique : nausées, vomissements. Réaction au site d’injection (rougeur) |
| Peu fréquents (≥ 1/1 000 à < 1/100) | Douleurs abdominales, lymphadénopathie, urticaire, diminution de l’appétit, léthargie, étourdissements, somnolence, hyperhidrose, prurit, éruption cutanée | Tremblement, éternuement, douleur oropharyngée, rash, hyperhidrose, faiblesse musculaire, extrémités douloureuses, dorsalgie, asthénie, malaise | Prurit au site d’injection | Douleur aux extrémités, lymphadénopathie, insomnies, malaise, prurit au site d’injection, réactions d’hypersensibilité (rash, prurit) |
| Rares (≥ 1/10 000 à < 1/1 000) | Hypersensibilité, urticaire | Paralysie faciale périphérique aiguë (paralysie de Bell) (3 cas sur 15 185 personnes vaccinées dans les essais cliniques), gonflement du visage. | Urticaire, angio-œdème, paralysie de Bell (4 cas sur 22 000 personnes vaccinées dans les essais cliniques). | |
| Très rare (≤ 1/10 000) | Réaction systémique : syndrome thrombotique thrombocytopénique | Thrombose en association avec une thrombocytopénie | ||
| Indéterminé | Anaphylaxie, hypersensibilité, fuites capillaires, angio-œdème | Anaphylaxie | Des réactions d’hypersensibilité, anaphylactiques et des myocardites/ à péricardites ont été rapportées | Des réactions anaphylactiques et des myocardites/péricardites ont été rapportées |
Pour qu’un vaccin soit De l’autre côté, Le CRESS (centre of research in epidemiology and statitics) recense et décrit des estimations en fonction des suites de l’infection au SARS-CoV-2 vacciné ou non. D’ailleurs ce site hors mis qu’il « a pour objectif de visualiser des données scientifiques publiées et n’a pas vocation à se substituer aux recommandations des autorités de santé ou à une consultation et discussion avec un médecin ».
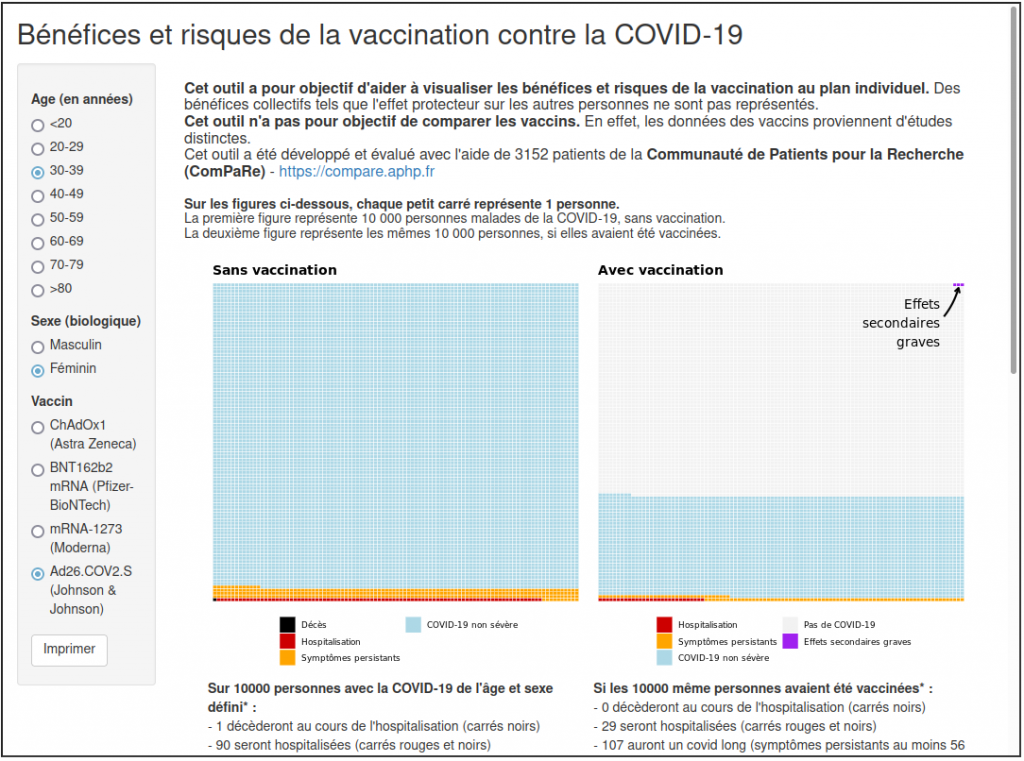
Le texte adopté n°654 dit « Petite loi » sera présenté devant le Conseil constitutionnel le 5 août 2021, avec le « passe sanitaire », « l’obligation vaccinale », la « suspension du contrat de travail »… à suivre…


Ping : Les vaccins et l’obligation vaccinale (1re partie) – Libre Expression
Ping : Et s’ils avaient raison ? – Libre Expression
Ping : L'ASSE en Uruguay subit une cyberattaque - Libre Expression
Ping : Suis-je complotiste ? (1ʳᵉ partie) - Libre Expression